
各位讀者好,今天為大家?guī)硪黄褂?/span>綜合運用網絡毒理學和分子對接等前沿研究手段并結合細胞實驗驗證來全氟辛烷磺酸(PFOS)誘導炎癥性腸病(IBD)的潛在靶點和機制的高分文章,是由山西醫(yī)科大學團隊2025年8月在International journal of surgery發(fā)表的,題為“Mechanistic insights into PFOS-induced inflammatory bowel disease a network toxicology and molecular docking study"。深入探究了全氟辛烷磺酸(PFOS)誘導炎癥性腸病(IBD)的潛在機制,為環(huán)境污染物的健康風險評估提供科學依據,強調降低PFOS暴露對IBD預防的重要性,推動相關公共衛(wèi)生政策和污染治理措施的實施。

發(fā)表雜志:
《International journal of surgery》是一本聚焦外科學領域的國際同行評審學術期刊,致力于發(fā)表外科學及相關交叉學科的高質量研究成果,為全球外科醫(yī)生、研究人員、醫(yī)學教育者提供專業(yè)的學術交流平臺,創(chuàng)刊于2003年,在國際外科領域具有廣泛的影響力。
2025 年影響因子:10.1
ISSN:1743-9191
中科院分區(qū):中科院分區(qū)大類學科為醫(yī)學2區(qū),小類學科為外科2區(qū)。
發(fā)文量:每年出版文章數平均約553篇
發(fā)表成本:發(fā)表研究論文、綜述和指導,需支付 3800 美元,約人民幣 3 萬元;發(fā)表信件和通信,需要支付 1900 美元,約人民幣 1.5 萬元。
審稿周期:采用 “快速同行評審" 機制,平均初審周期約 2-4 周,稿件錄用后在線發(fā)表(Online First)速度快,通常 1-2 個月內可上線,有助于研究成果的快速傳播
《International Journal of Surgery》是外科學領域的國際核心期刊,以 “覆蓋全外科領域、發(fā)表高質量研究、推動全球外科交流" 為目標,具有影響因子高、國際認可度強、審稿效率快等特點。無論是臨床醫(yī)生發(fā)表創(chuàng)新手術研究,還是科研人員分享外科基礎轉化成果,或是領域專家撰寫quan威綜述,該期刊都是重要的學術平臺,對推動全球外科學的發(fā)展具有重要作用。
研究背景:
全氟辛烷磺酸(PFOS)作為持久性有機污染物,廣泛存在于環(huán)境中,通過飲水和食物鏈造成人類普遍暴露。全球炎癥性腸病(IBD)發(fā)病率上升與PFOS污染在時空上相關,但其誘導IBD的分子機制尚不明確。已有研究表明PFOS可能通過破壞腸道屏障、誘導炎癥反應等影響腸道穩(wěn)態(tài),但環(huán)境暴露劑量與遺傳易感性如何相互作用調控IBD表型仍需闡明。鑒于PFOS的環(huán)境持久性和健康風險,亟需明確其觸發(fā)IBD的分子起始事件,以完善炎癥相關疾病的“同一健康"范式,為污染治理和疾病預防提供依據。
該研究旨在闡明全氟辛烷磺酸(PFOS)誘導炎癥性腸病(IBD)的作用機制。通過網絡毒理學和分子對接技術,篩選PFOS毒性靶點與IBD相關基因的交集,識別核心靶點并驗證其相互作用,結合細胞實驗探討PFOS對腸道屏障功能和炎癥因子的影響,揭示PFOS通過干擾關鍵蛋白及信號通路參與IBD發(fā)病的潛在機制,為環(huán)境健康風險評估和IBD防治策略提供理論依據。
研究框架:
1.提出問題:
PFOS作為環(huán)境污染物,其與IBD發(fā)病的分子機制及關鍵靶點尚不明確,需探究二者間的 mechanistic link。
2. 研究框架:
整合PFOS毒性靶點與IBD相關基因,通過數據庫挖掘、網絡分析篩選交集靶點,結合分子對接和細胞實驗驗證機制。
3. 研究方法:
采用網絡毒理學(數據庫篩選靶點、PPI網絡構建、GO/KEGG富集分析)、分子對接(AutoDock Vina)及細胞實驗(MTT、qRT-PCR、Western blot、CETSA等)。
4. 分析數據:
對篩選出的靶點進行功能富集分析,通過分子對接評估PFOS與核心蛋白結合能力,細胞實驗檢測炎癥因子及屏障蛋白表達變化。
5. 研究結論:
綜合多組學和實驗結果,闡明PFOS通過靶向關鍵蛋白(如ALB)、干擾信號通路(如炎癥、屏障功能相關通路)誘導IBD的機制。

Fig.1工作流程示意圖
結果解析:
1. PFOS毒性靶點的數據庫整合分析
通過ChEMBL、STITCH和SwissTargetPrediction數據庫交叉篩選,識別出PFOS的63個潛在毒性靶點,為后續(xù)分析PFOS與炎癥性腸病(IBD)的關聯提供候選蛋白基礎。

2. PFOS與IBD共同靶點的篩選與識別
從GeneCards、OMIM等數據庫獲取10297個IBD相關基因,與PFOS毒性靶點取交集后得到30個共同靶點,提示這些基因可能是PFOS誘導IBD的關鍵分子媒介。

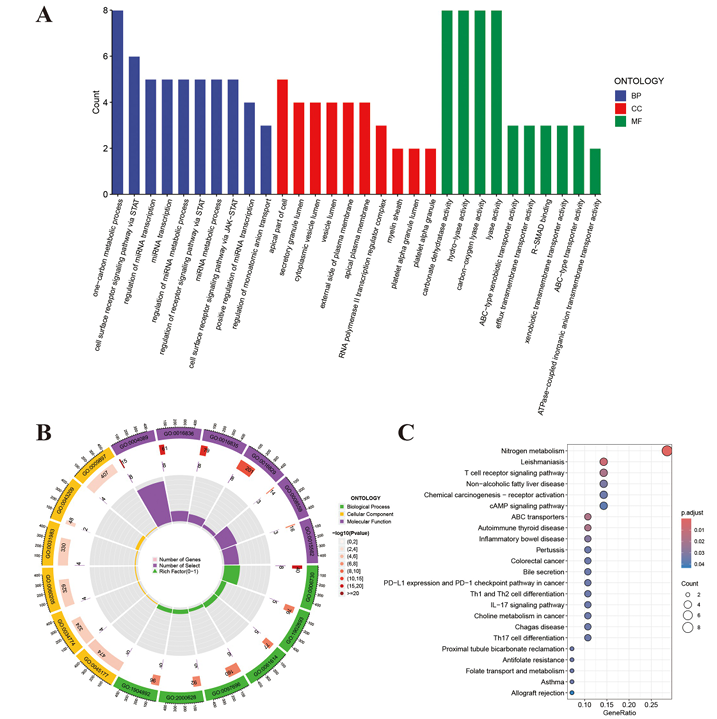
3. GO和KEGG富集分析揭示PFOS致IBD的核心通路
基因本體論(GO)分析顯示PFOS影響碳代謝、細胞表面受體信號等生物學過程;KEGG通路分析富集到氮代謝、T細胞受體信號等通路,提示PFOS可能通過免疫調節(jié)和代謝紊亂參與IBD發(fā)病。
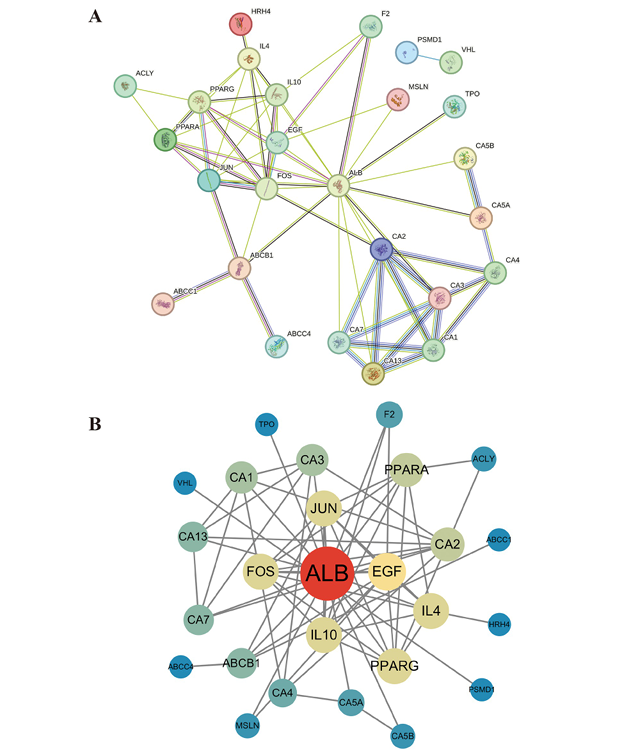
4. PFOS與IBD共同靶點的蛋白質相互作用(PPI)網絡
構建30個共同靶點的PPI網絡,核心基因包括白蛋白(ALB)、表皮生長因子(EGF)、原癌基因FOS、白細胞介素-10(IL-10)等,這些蛋白在網絡中具有高連接度,可能是PFOS干擾腸道穩(wěn)態(tài)的關鍵節(jié)點。
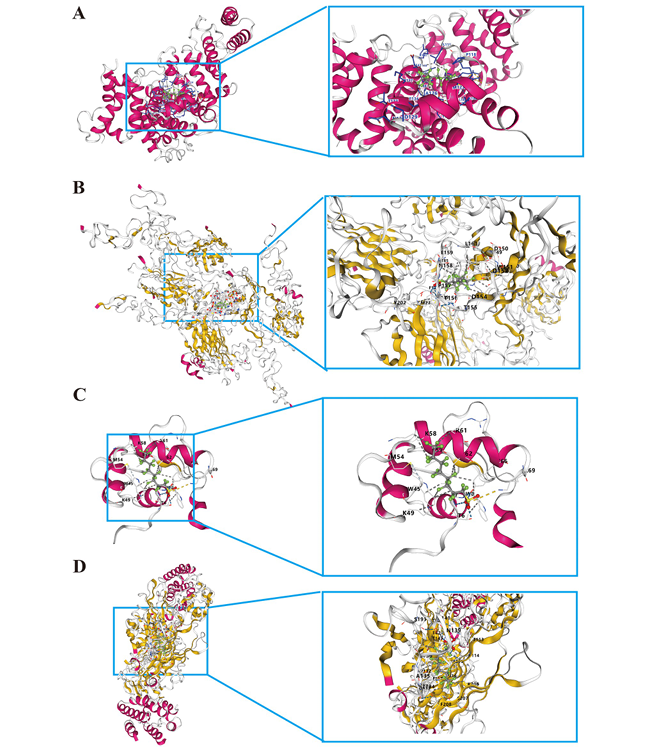
5. PFOS與核心靶點蛋白的分子對接驗證
分子對接顯示PFOS與ALB(Vina score=-8.9)、EGF(-7.9)、FOS(-6.2)、IL-10(-8.4)均存在穩(wěn)定結合,通過氫鍵等相互作用影響蛋白功能,提示PFOS可能直接靶向這些分子觸發(fā)炎癥反應。
6. PFOS通過靶向ALB破壞腸屏障功能并誘導IBD樣表型
體外實驗表明,4μM PFOS可抑制結腸上皮細胞(NCM460)增殖,上調促炎因子(IL-1β、TNF-α等),下調緊密連接蛋白(ZO-1、Occludin)及ALB表達;細胞熱位移實驗(CETSA)證實PFOS增強ALB熱穩(wěn)定性,提示ALB是PFOS干擾腸道屏障的關鍵靶標。

研究結論:
該研究揭示了PFOS暴露與IBD間的潛在機制聯系,PFOS通過與ALB、EGF、FOS、IL-10等核心蛋白結合,干擾炎癥信號通路和腸道屏障功能,誘導IBD發(fā)生發(fā)展,為環(huán)境健康科學和公共衛(wèi)生政策提供新視角。
研究的創(chuàng)新性:
整合網絡毒理學、PPI網絡分析與分子對接技術,從多維度篩選并驗證PFOS誘導IBD的關鍵靶點和通路,shou次明確ALB在PFOS致IBD中的作用,為環(huán)境污染物與疾病機制研究提供新范式。
研究的不足之處:
缺乏流行病學數據驗證PFOS暴露與IBD發(fā)病率的直接關聯;細胞實驗僅使用單一細胞系,未涉及動物模型或人體樣本;未深入探究PFOS與遺傳易感基因的相互作用。
研究展望:
開展縱向流行病學研究,驗證PFOS暴露與IBD發(fā)病的因果關系;建立動物模型或利用人體樣本,進一步驗證PFOS對腸道炎癥的影響及機制;探究不同人群對PFOS暴露的敏感性差異,為精準預防提供依據;開發(fā)靶向PFOS影響通路的干預策略,探索降低PFOS暴露以緩解IBD的可能性。
研究意義:
闡明PFOS誘導IBD的分子機制,為環(huán)境污染物的健康風險評估提供科學依據;揭示ALB等核心蛋白在IBD發(fā)病中的作用,為IBD防治提供潛在靶點;強調降低PFOS暴露對IBD預防的重要性,推動相關公共衛(wèi)生政策制定和污染治理措施實施。